今年诺贝尔化学奖由三位科学家下村脩(Osamu Shimomura)、Martin Chalfie 和钱永健 (Roger Tsien)三人分享,代表了绿色荧光蛋白研究上的三个里程碑。我曾经在这个领域工作过,对这段历史还略有了解。
下村脩1962年在普林斯顿大学做研究的时候从一种水母身上分离出绿色荧光蛋白(GFP)。当时知道在蓝紫色光的照射下,它会发出绿色荧光。后来他搬到波士顿郊外的小镇Woods Hole上著名的海洋生物实验室(MBL)。GFP的结构以及发光原理,要到1990年代通过X光衍射才得到证实:GFP的肽链构成一个桶状结构,在其中心由3个氨基酸携带的芳香基团构成了发光核心结构。
一直到1990年代,GFP才重回生物学家的视野。这里其实还有另一位生物学家的重要贡献,Douglas Prasher 1992年在Woods Hole 海洋研究所(WHO)克隆出了GFP基因,随后哥伦比亚大学的 Martin Chalfie 成功地让GFP基因在大肠杆菌和线虫(C. Elegan)上表达成功。这个实验的重要意义,是证明从水母上分离出来的GFP基因可以在其它物种上表达,正确地折叠,发出荧光。这些研究成果为GFP在生物学研究上的使用,奠定了基础。
当时如果要研究活体生物中的生命活动,可以采用往细胞体内注射荧光化合物,或者是事先把荧光化合物结合到蛋白上,然后注射到细胞内的方式。钱永健此时已经是这个领域的专家,他发明的荧光化合物 fura-2 会随着周围钙离子浓度变化而改变荧光强度,经常被用来研究活体细胞内的钙离子浓度变化。但是这种方法的缺点也很明显,第一荧光化合物可能有毒性,影响正常生理活动;第二把荧光化合物特别是标记了荧光化合物的蛋白注射到细胞内,需要特别的设备和专业训练——微注射;第三即使荧光化合物无毒,也有微注射的条件,每研究一种蛋白,就必须先分离蛋白,然后找到标记荧光化合物的办法。这些困难,限制了普通生物学家研究活体生物活动的能力。
与此同时,在1990年代初分子生物学在聚合酶链式反应(PCR)技术的发展推动下,已经有了很强的操纵基因的能力。比起蛋白来,在DNA水平上对基因进行裁接和修饰已经是实验室常规操作。如果GFP可以在各个物种中准确折叠发出荧光,那么只要在基因水平上把研究者感兴趣的蛋白基因,接上GFP基因,然后转移到细胞内表达,就等于给被研究的蛋白带上了一个荧光标签。而这一切完全不涉及蛋白提纯,标记,蛋白微注射等技术,也就是说,任何一个分子生物学家都有可能用荧光标记自己研究的对象。而且GFP是一种无害无作用的蛋白,不用担心对细胞产生毒性。
钱永健的贡献,是利用他在活体荧光研究方面的丰富经验,对GFP进行改造,他的实验室利用定点突变改造出来 EGFP,不仅提高了荧光强度,更重要的可以在普通的荧光显微镜下用现有的荧光滤镜观察到,而且光谱单一,不会和其它荧光染料的光谱发生干扰。接着他的实验室又陆续推出了不同颜色的 GFP,如蓝色(BFP)和黃色(YFP)的荧光蛋白。不同颜色不是为了好看,而是为了可以同时在同一个细胞或组织内标记多种蛋白或结构,或者是在研究中把GFP标记蛋白与其它荧光化合物同时使用。现在世界各地实验室使用的GFP,都是经过改造优化了的,钱永健是这方面的先驱和领先人物。在他在加州大学圣地亚哥分校的实验室网站上,有一幅用表达了多种颜色荧光的大肠杆菌组成的照片。
多种颜色GFP的出现,还为以后研究蛋白之间的相互作用,蛋白分解等提供了无限的可能性。生物学家可以同时对多种基因进行荧光标记,然后根据活体内的荧光颜色变化,判断生物活动进程,此时荧光标记不再是标记蛋白在哪里,还能标记活体内的生物事件。
可以说,GFP在细胞生物学研究上的重要性,不亚于PCR技术对分子生物学发展的意义。
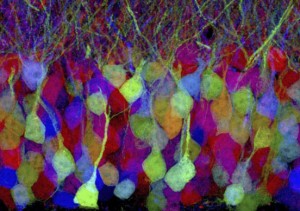
这张照片就是GFP技术的运用之一。哈佛大学细胞分子生物学系和脑科学中心的研究人员使用转基因技术,使得小鼠脑部邻近神经元可以随机地表达不同颜色的GFP(他们称之为XFPs)。在荧光显微镜下,可以清楚地分辨通常是交缠在一起的大量神经元构成的复杂网络,可以用来跟踪神经元之间的关系。文章发表在去年11月的《自然》(Nature)杂志。